Rejestracja leków, czyli dopuszczenie ich do obrotu na rynku polskim, odbywa się za pomocą różnych procedur rejestracyjnych. Jakie to procedury oraz które z nich przeważają wśród leków refundowanych?
Leki refundowane - w jakich procedurach zostały dopuszczone do obrotu?
Niemal dla wszystkich leków umieszczonych w wykazie refundacyjnym zgromadziliśmy informację o procedurze dopuszczenia do obrotu w Polsce, a następnie sprawdziliśmy która z procedur jest najczęściej obserwowana wśród tych leków.
Przeprowadzona analiza wykazuje, że w każdym z trybów dostępności refundacyjnej obserwowana jest inna dominująca procedura rejestracyjna:
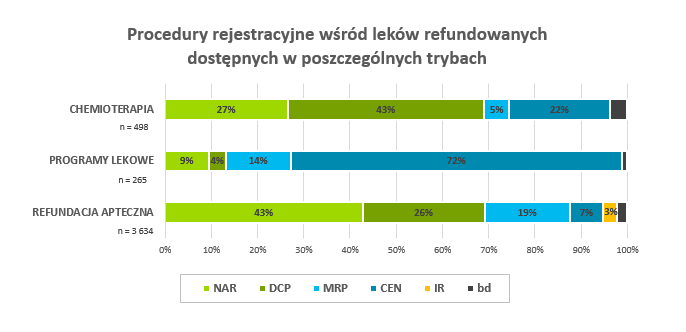
- leki dostępne w trybie refundacji aptecznej przeważnie podlegają rejestracji w procedurze narodowej (NAR; 43%);
- w przypadku leków dostępnych w trybie programów lekowych dominuje rejestracja centralna (CEN; 72%);
- chemioterapeutyki z kolei najczęściej znajdują się w obrocie w wyniku rejestracji w procedurze zdecentralizowanej (DCP; 43%).
 Informacja o procedurze dopuszczenia do obrotu leków objętych refundacją, na podstawie której wykonana została prezentowana tu statystyka, dodana została do Refundacyjnej Bazy Danych MEDI.base (pakiet: 'REJESTRACJA').
A już wkrótce MEDI.base wzbogacona zostanie o kolejną informację: datę pierwszej rejestracji (DPR) każdego refundowanego opakowania leku.
Poniżej przedstawiono krótką charakterystykę procedur rejestracyjnych, o których mowa w przedstawionej statystyce.
Informacja o procedurze dopuszczenia do obrotu leków objętych refundacją, na podstawie której wykonana została prezentowana tu statystyka, dodana została do Refundacyjnej Bazy Danych MEDI.base (pakiet: 'REJESTRACJA').
A już wkrótce MEDI.base wzbogacona zostanie o kolejną informację: datę pierwszej rejestracji (DPR) każdego refundowanego opakowania leku.
Poniżej przedstawiono krótką charakterystykę procedur rejestracyjnych, o których mowa w przedstawionej statystyce.
Procedura centralna (CEN)
W procedurze centralnej rejestracji wydawane jest pozwolenie na dopuszczenie do obrotu, które obowiązuje we wszystkich państwach członkowskich oraz na Islandii, w Liechtenstein i Norwegii. Takie pozwolenie wydaje Komisja Europejska, a za rozpatrzenie wniosku odpowiada Europejska Agencja Leków (European Medicines Agency - EMA).
Procedura centralna jest obowiązkowa m.in. w przypadku leków:
- stosowanych u ludzi w leczeniu HIV/AIDS, nowotworów złośliwych, cukrzycy, zaburzeń neurodegeneracyjnych, chorób autoimmunologicznych i innych dysfunkcjach immunologicznych, chorób wirusowych;
- wytwarzanych w procesach biotechnologicznych;
- stosowanych w terapii zaawansowanej, np. w terapii genowej;
- stosowanych w chorobach rzadkich tzw. leków sierocych.
Procedura narodowa (NAR)
Procedura prowadzona jest według przepisów mających zastosowanie w danym kraju. W Polsce dopuszczeniem leku do obrotu w procedurze narodowej zajmuje się Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL).
Procedura wzajemnego uznania (MRP)
Procedura MRP (z ang. Mutual Recognition Procedure) dotyczy produktów, które posiadają już pozwolenie na dopuszczenie do obrotu w jednym z krajów EU. Polega ona na rejestracji produktu w kolejnych krajach poprzez uznanie wydanego przez państwo referencyjne pozwolenia na dopuszczenie do obrotu.
Procedura zdecentralizowana (DCP)
Procedura DCP dotyczy leku jeszcze niezarejestrowanego w żadnym państwie członkowskim. Polega ona na rejestracji leku równolegle w kilku krajach EU. We wniosku o rejestrację musi zostać wskazany kraj, który będzie pełnił rolę państwa referencyjnego, odpowiedzialnego za wstępną ocenę i koordynację całego procesu.
Import równoległy (IR)
Procedura importu równoległego dotyczy sprowadzenia leków, które zostały wyprodukowane na rynek europejski inny niż polski. Leki te nie różnią ani jakością ani skutecznością terapeutyczną od leków przeznaczonych na rynek polski. Różnice dotyczą jedynie wyglądu opakowań. Pozwolenie na import równoległy jest wydawane na 5 lat.

